Activités
Fiches documentaires
Introduction à l’astrochimie Lycée

I – Introduction
Depuis des siècles, les hommes observent le ciel et cherchent à comprendre les très nombreux phénomènes découverts au fur et à mesure des avancées technologiques. Cependant, il a fallu attendre très longtemps, à la fin des années 1930 avec le développement de la spectroscopie et de la radio astronomie pour que l’existence de réactions chimiques dans les milieux interstellaires soit constatée et étudiée. En commençant par des molécules simples CH ou CN dans les années 1940 puis en passant par des molécules plus complexes comme le formaldéhyde en 1969, on observe l’existence de molécules de plus en plus complexes créées dans les proto-étoiles, dans les disques proto-planétaires ou dans les nuages de gaz.
2 – Observations
La détection et l’identification de molécules lointaines ne peut bien entendu pas dépendre d’analyses chimiques en laboratoire. Les distances mises en jeu ne permettent pas d’envisager la récupération d’échantillon. Comme souvent l’étude des rayonnements vient à notre secours. Comme il s’agit de détecter des molécules, nous recherchons dans le spectre lumineux des objets étudiés, des raies dont les longueurs d’onde correspondent aux énergies de vibration ou de rotation de la molécule. L’image suivante donne des exemples de vibrations et rotations possibles pour la molécule d’eau :
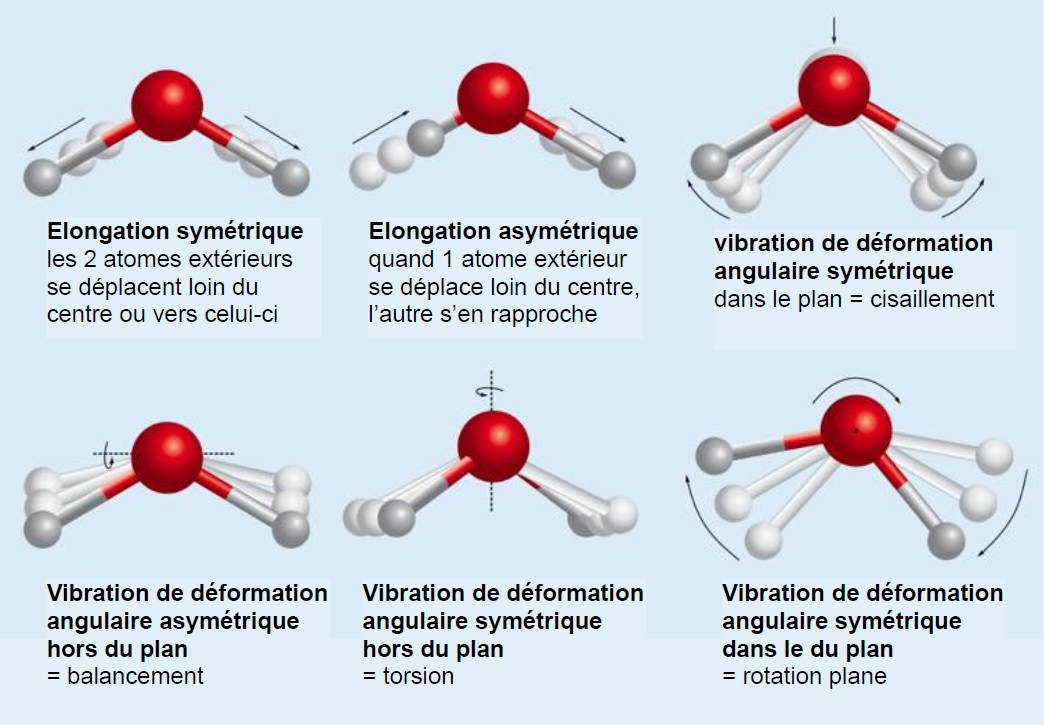
Or cette énergie est assez faible, de l’ordre de 40 kJ.mol-1 pour la vibration (à comparer aux 400 kJ.mol-1 pour l’énergie de liaison).
Pour une molécule cette énergie correspond à l’énergie d’un photon de longueur d’onde d’environ 3 mm. Il va donc falloir observer dans l’infrarouge : il s’agit de la spectroscopie infra-rouge bien connue des chimistes.
Si on considère l’énergie de rotation des molécules, l’énergie est encore plus faible, de l’ordre de 40 J.mol-1, et une longueur d’onde d’environ 3 mm qui correspond à des micro-ondes.
Nous venons donc d’établir que l’observation des molécules grâce à un spectre lumineux est possible en théorie, si on observe dans l’infra-rouge ou dans le domaine des micro-ondes.
Cependant cette observation est fortement perturbée par notre atmosphère qui contient de nombreuses molécules qui vont elles-mêmes absorber la lumière des objets lointains que nous cherchons à analyser.
C’est le cas tout particulièrement de la vapeur d’eau qui absorbe très fortement.
Le document suivant montre la transmittance de l’atmosphère en fonction de la longueur d’onde :
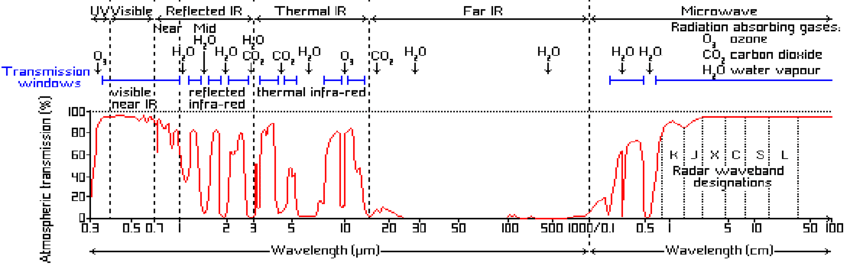
Que constate-t-on ?
Dans la zone qui nous intéresse, certaines fenêtres d’observation sont accessibles, mais d’autres sont totalement bloquées (en particulier entre 15 et 1000 mm.
Il va donc être possible de réaliser des observations depuis le sol mais sans avoir accès à certaines informations pour lesquelles il faudra s’extraire de l’atmosphère terrestre.
3 – Exemple d’observation depuis le sol
Les articles « Une nouvelle molécule détectée dans un disque proto-planétaire » du site du CNRS-INSU (Institut national des sciences de l’Univers) et « Une nouvelle molécule détectée dans un disque proto-planétaire » du site de l’IRAP (Institut de Recherche en Astrophysique et Planétologie) font référence à une publication de chercheurs européens et asiatiques qui ont utilisé l’interféromètre NOEMA de l’IRAM (Institut de Radioastronomie Millimétrique) pour observer le disque proto-planétaire autour de l’étoile triple GG Tau.

Crédits : IRAM, DiVertiCimes
On constate à la lecture de l’article que l’observation a été réalisée dans une fenêtre très précise de longueur d’onde : entre 2,6 et 4mm.
Pourquoi ces longueurs d’onde ont été choisies pour l’observation : tout simplement parce que l’atmosphère laisse passer suffisamment de rayonnement dans cette plage pour permettre une analyse des spectres et que de nombreuses molécules présentent des raies de rotation dans cette zone.
D’ailleurs l’observation a permis d’identifier 38 molécules différentes, dont une découverte pour la première fois dans un disque proto-planétaire : le CCS (thioxoéthénylidène).
Beaucoup des molécules observées ne seraient pas stables dans les conditions habituelles dans lesquelles nous nous trouvons et ne peuvent exister que dans des milieux très différents du nôtre, mais certaines sont beaucoup moins exotiques. On peut reconnaître par exemple : CO, HCN, SO2, CH3CN, …
Une grande variété de molécules est présente dans ce disque proto-planétaire et les chercheurs tentent de modéliser les transformations chimiques qui peuvent expliquer les abondances des différentes espèces.
4 – Observation depuis l’espace
On a vu ci-dessus que l’exploration du ciel dans les longueurs d’onde du domaine des infra-rouges ou des micro-ondes est assez limitée par les absorptions de l’atmosphère. La solution pour pouvoir observer dans des domaines interdits est donc de s’extraire de l’atmosphère.
Le télescope JWST (James Webb Space Telescope) en est un exemple frappant et très récent.
Il permettra d’observer dans l’infra-rouge proche et moyen avec une bonne résolution. Cette fois encore l’infra-rouge pose des difficultés car la résolution d’un instrument dépend directement de la longueur d’onde observée et du diamètre du télescope utilisé.
On peut par exemple déterminer le rayon d’une tache provoquée par un objet ponctuel (une étoile peu brillante) sur le capteur du télescope. Ce rayon est lié à la figure de diffraction provoquée par l’ouverture du télescope. On parle de tache d’Airy et on a la relation :
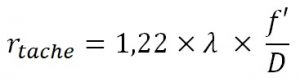
Avec : rtache : le rayon de la tache
λ : la longueur d’onde observée
f’ : la distance focale du télescope
D : le diamètre du télescope
Pour une focale donnée, si la longueur d’onde est multipliée par 2, il faut donc un télescope de diamètre 2 fois plus grand pour garder une tache de diffraction aussi petite et donc conserver la même résolution.
Par exemple, si on considère que le télescope spatial Hubble observe dans le visible (l = 500 nm), sachant que son diamètre est de 2,40 m et sa distance focale de 57,60 m on obtient une tache :
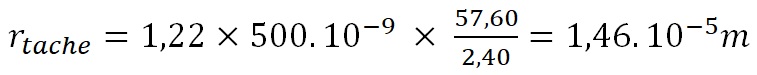
soit environ 15 microns.
Cela correspond à la taille des pixels de l’imageur WFC3, le plus récent installé sur Hubble.
Si maintenant on cherche à observer dans le proche infra-rouge, par exemple à 1500 nm, la longueur d’onde ayant été multipliée par 3, la tache le sera aussi (45 microns de diamètre), et donc la résolution diminue.
Appliquons la même relation au JWST avec un diamètre impressionnant de 6,5 m et une focale de 131,4 m.
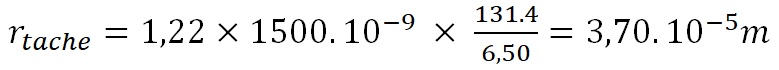
soit environ 37 microns.
Avec une taille de pixels de 18 microns, 2 pixels de l’imageur NIRCam sont donc activés en moyenne simultanément contre 3 ou plus pour Hubble.
Que va donc permettre le télescope JWST ? L’article « Le satellite Webb de la NASA étudiera l’influence du rayonnement des étoiles massives sur leur environnement » nous donne un aperçu des attentes que suscite ce nouvel outil d’observation.

On comprend qu’il va être possible d’analyser beaucoup plus finement les endroits dans les nuages interstellaires où les molécules se forment ou sont dissociées, ce qui est particulièrement intéressant pour mieux comprendre les processus physico-chimiques qui conduisent à la production de molécules complexes.
Là encore des études permettent de prévoir et mieux comprendre les mécanismes mis en jeu dans ces zones frontières où les liaisons interatomiques sont possibles grâce à des conditions favorables d’énergie et de densité.
5 – Idées d’activités avec les élèves
5.1 – Exercices sur les longueurs d’onde et les photons
A partir de la Spécialité Physique-Chimie de classe de Première, les élèves découvrent la notion de longueur d’onde, souvent à travers l’étude des ondes sonores. Cette notion est réinvestie pour introduire le photon et la relation liant l’énergie du photon à la fréquence de la radiation émise, puis à sa longueur d’onde dans le vide.
On peut donc par exemple se baser sur OH et faire calculer l’énergie des photons émis pour les raies caractéristiques à 53 μm, 79 μm, 84 μm, 119 μm et 163 μm, ou inversement donner les énergies et demander de calculer la longueur d’onde des raies.
On peut faire comparer ces énergies à l’énergie de liaison covalente OH (460 kJ.mol-1) et faire réfléchir les élèves sur le type de phénomènes qui peuvent provoquer ces raies et dans quelles conditions elles peuvent être analysées.
Pour aller plus loin, on peut aussi faire calculer l’énergie thermique fournie à OH (on le traite comme un gaz diatomique de capacité thermique à volume constant Cv = 5R/2 = 21 J.K-1.mol-1 qu’on considère comme constante) en imaginant qu’on a fait passer de 0 K à 298 K sans changement d’état une mole de gaz, en utilisant la relation :
Q = n . Cv (Tf – Ti)
On est bien sûr dans une très grande approximation mais on peut ainsi vérifier que les longueurs d’onde correspondent à des états qui sont forcément activés dans nos conditions habituelles.
5.2 – Exercices de chimie
On peut faire travailler les élèves sur des molécules connues simples présentes dans l’espace, telles que l’eau, l’ammoniac, le chlorure ou le fluorure d’hydrogène, le monoxyde de carbone.
D’autres molécules plus exotiques seraient très compliquées à appréhender, même au lycée où les connaissances de chimie restent basiques et surtout n’abordent que les réactions réalisées dans des conditions habituelles (25°C et pression atmosphérique).
On peut donc s’appuyer sur ces molécules simples, comme des précurseurs d’autres réactions. Il est aussi utile de faire comprendre aux élèves que les réactions chimiques ne sont pas uniquement terrestres et que des espèces chimiques mises en présence peuvent réagir si elles disposent de suffisamment d’énergie et de probabilité de rentrer en contact.
5.3 – Exercices d’optique
On pourrait imaginer de nombreux exercices autour des télescopes comme Hubble ou le JWST. Cependant, le télescope n’est plus étudié au lycée et seule la lunette astronomique l’est en Spécialité Physique-Chimie de Terminale (la relation de conjugaison de Descartes pour les lentilles minces convergentes est quant à elle introduite en Spécialité de Première).
On ne peut donc qu’imaginer des activités de découverte autour de relations données (telles que le rayon de la tache d’Airy), qui peuvent servir à manipuler les outils mathématiques (proportionnalité, fractions, …) et aborder des outils de la physique (ordres de grandeur, chiffres significatifs, éventuellement les incertitudes, …). Ce genre d’activité peut assez facilement trouver sa place en classe de Seconde ou en début d’année de Spécialité de Première.
Article réalisé avec l’aide de Audrey Coutens et Olivier Berné, tous les deux astrophysiciens à l’IRAP
Documents associés
Découverte de grandes molécules aromatiques polycycliques interstellaires dans l’astéroïde Ryugu
Le dioxygène dans les océans
Le mercure
Géotraces
Conversion d’énergie éolienne et point de fonctionnement
Campagne en mer SWINGS
La parallaxe grâce au satellite Gaia
Documents et modules pédagogiques à partir du projet SWINGS.
Histoire de la cristallographie
Physicien – Jean-Michel Courty
Planétologue – Michael Toplis
Météoritologue – Brigitte Zanda
Jets géants
Mars, Curiosity et ChemCam
La Planeterrella
Chercheur – Biogéochimiste
Chercheur en génie des procédés – Stéphane Sarrade
Assistant ingénieur – Laurent Labadie
Docteur en chimie – Laurent Boiteau
